藥品專利鏈接制度解讀:創新藥企、仿制藥企你們準備好了嗎?

2017年10月8日,中共中央辦公廳、國務院辦公廳聯合印發《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(以下簡稱《意見》),引發了知識產權、醫藥、投資機構、法律界的大討論。
《意見》的15-19條給出了藥品專利鏈接制度的整體框架設計,未來還將進一步細化具體的制度設計。該意見中第16項明確提出要探索建立藥品專利鏈接制度,這是我國首次明確提出要建立專利鏈接制度。
專利鏈接制度的歷史沿革
藥品專利鏈接制度起源于美國。1984年,美國通過了著名的Hatch-Waxman法案,該法案包括ANDA(簡略新藥申請)、藥品專利鏈接制度、藥品專利保護期補償、Bolar例外、數據保護等幾個方面。
此后,加拿大、澳大利亞、韓國等國家通過與美國簽定自由貿易協定,相繼引入了專利鏈接制度,但歐盟、瑞士、日本、印度至今尚未建立這樣的制度。
美國鏈接制度流程
美國鏈接制度從整體上可以分為4大塊:桔皮書制度、專利聲明制度、遏制期制度、首仿藥市場獨占期制度。
首先來看桔皮書制度。這一制度要求原研藥企業在申請藥品上市時需要提交專利信息,在原研藥上市之后,FDA(美國食品藥品監督管理局)會將相關專利信息登記在桔皮書中。桔皮書的信息提供了專利鏈接制度的基礎。12月28日,食品藥品監督管理總局發布了我國第一批上市藥品目錄集,類似于美國的桔皮書,在目錄集后的附錄里收錄了藥品相關專利。
仿制藥提出申請時,就要針對桔皮書里面列出的每一個專利,做出專利聲明。美國的專利聲明可以劃分稱為兩大類,第一大類就是我們通常所謂的certification,另外一大類包括兩個statement。
通常certification包括四小類:第I段聲明是,桔皮書里面沒有列出相關專利;第II段聲明是,桔皮書所列出的專利已經過期;第III段聲明是,桔皮書所列的專利過期前仿制藥不會上市;第IV段聲明是最重要、最核心的一類聲明,即聲明桔皮書所列的專利無效、不可實施或者生產上市仿制藥不會侵犯專利權,也就是我們通常所稱的“專利挑戰”。
再看那兩個statement。第一個statement也稱為小viii項聲明,針對的是藥品使用方法專利。如果一個原研藥有多個適應癥,只有部分適應癥是受專利保護的情況下,仿制藥企業可以在其仿制藥上市申請中將受到專利保護的適應癥刪除,即不尋求獲得批準受專利保護的適應癥,那這個仿制藥就不會侵犯該使用方法專利,這個時候可以作出這樣的聲明。第二種statement是沒有專利的聲明,可以聲明說沒有專利。
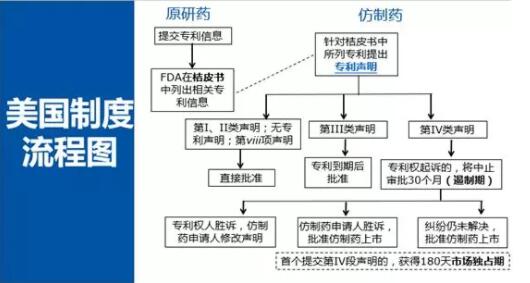
無專利statement和第I段certification有什么區別呢?根據FDA的解釋,如果作出的是無專利statement,就是指仿制藥申請人認為不存在相關專利;而提出第I段certification則是指仿制藥申請人認為存在相關專利,但是在桔皮書中沒有列出。
收到仿制藥申請人的專利聲明之后,FDA會根據不同的聲明做出相應的處理。如果提出的是第I、II段聲明、以及無專利的第viii項聲明的情況下,FDA會直接批準;如果提出的是第III段聲明,FDA會在專利到期后批準;如果仿制藥企業提出的是第IV段聲明(專利挑戰),則仿制藥企業需要通知專利權人及原研藥企業,專利權人在收到通知之后45天之內可以起訴,起訴的話就進入了一個非常重要的程序---遏制期,這個時候FDA會中止審批長達30個月,但是不會停止接受審評,中止審批的目的是等待法院解決專利侵權糾紛。如果在30個月以內,法院判定專利權人勝訴,也就是仿制藥侵犯專利權,那么仿制藥不能直接獲得審批,一般會要求仿制藥申請人修改聲明,即需要等到專利過期之后才能獲得上市許可。如果專利挑戰成功了,也就是仿制藥企業勝訴,在判決做出后,FDA會直接審批上市。如果等到了30個月,訴訟仍未解決,那么FDA也會批準仿制藥上市。這就是整個鏈接制度的流程。
此外,還有一個非常重要的制度---首仿藥的市場獨占期制度,指的是首個提交專利挑戰的仿制藥企業可以獲得180天的市場獨占期。
實際上,中國的鏈接制度整體框架和美國的框架是一樣的,但還有許多地方需要進一步細化。
主要國家鏈接制度比較

從制度框架上來看,美國、加拿大、韓國的鏈接制度基本一樣,只是細節上存在區別。第一個較大的區別是適用范圍,美國的鏈接制度只適用于化學藥,而加拿大、韓國除了化學藥外還適用于生物制劑。第二個區別是遏制期不同,美國的遏制期長達30個月,加拿大是24個月,韓國9個月。值得注意的是,在加拿大的專利鏈接制度中,專利權人可以放棄遏制,后面會講到在什么情況下會選擇放棄。第三個區別是首仿藥市場獨占期,美國為180天,加拿大沒有獨占期,韓國是9個月。
既然美國的生物類似物不適用于專利鏈接制度,那生物類似物上市遵循怎樣的流程呢?美國有一套獨特的制度叫“專利舞蹈”(Patent Dance)。這項制度是通過2009年《生物制品價格競爭和創新法案》所建立的一套制度,2010年生效。這項制度非常有意思,它要求在生物類似物上市申請受理之后,上市申請人和參比制劑企業 (PRS)通過一系列的程序,互相交換信息,交換專利清單,對所涉及的專利進行協商,以就專利清單達成一致。
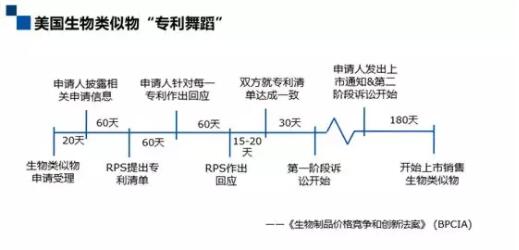
從上圖可以看到,申請人走一步,PRS走一步,申請人再走一步,PRS再走一步,這樣一來一回,非常像兩個人在跳舞,所以被稱為“專利舞蹈”。在跳完這場舞之后,專利權人就可以可以開始第一階段訴訟。但與鏈接制度有很大區別的是,盡管專利權人可以在生物類似物上市審批期間提起第一階段訴訟,但是訴訟不影響生物類似物的上市審批。接著從生物類似物企業計劃上市銷售生物類似物這個時點往前推180天,申請人需要發出上市通知,PRS在收到上市通知之后,可以開始第二階段訴訟,期間可以請求臨時禁令。
制度實施效果
從制度層面來看,美國醫藥產業的發展是多種制度共同作用的結果,很難簡單地說是哪一個制度促進了美國醫藥產業的發展。對于仿制藥產業而言,影響它發展的因素至少包括以下幾個方面:第一是簡化了仿制藥申請和審批程序、降低了成本的ANDA制度,我個人認為這是最重要的一點;第二是大家都熟悉的Bolar例外制度;第三是專利鏈接制度;第四是美國八十年代基本上50個州都出臺了“仿制藥替代法”,旨在鼓勵甚至要求用仿制藥來替代原研藥,除非醫生明確說只能用原研藥。最后還有一點雖不屬于制度因素,但也十分重要,即這幾十年來大量的專利到期,這顯然也會影響到仿制藥的占比。
對于創新藥來說,從知識產權制度來看,促進它發展的因素是多重的,比如藥品數據保護,專利保護期限延長以及專利鏈接制度。客觀的說,藥品專利鏈接制度對產業的發展到底起了一個什么樣的作用呢,我們很難從數據里面去得出一個確切的答案。
小結
公示專利信息
通過桔皮書制度,公示藥品相關專利信息,有利于專利保護和仿制藥企業制定生產上市計劃
提前解決專利糾紛
專利糾紛的解決時機提前至藥品上市審批階段,有利于侵權糾紛的及早解決,既有利于專利保護,又有利于提前上市仿制藥的法律確定性
鼓勵“專利挑戰”
通過對首仿要給予一定時間的市場獨占期,鼓勵仿制藥企業提出專利挑戰,有利于仿制藥及早上市.
上市仿制藥仍然存在侵權可能
值得注意的是,鏈接制度設計本身存在一些問題,同時還可能被濫用。首先,從制度效果上來說,鏈接制度希望能提前解決專利糾紛,提高仿制藥上市的確定性,但鏈接制度在解決專利糾紛方面的效果是有限度的,它并不能解決所有專利糾紛。也就是說,即使有了鏈接制度,上市以后的仿制藥仍然有可能面臨專利糾紛,因為鏈接制度針對的是桔皮書里面所列出來的專利,但是這些僅僅是一部分專利,包括化合物、組合物、劑型以及藥品的使用方法(我國稱之為制藥用途),沒有列進桔皮書里面去的就不能適用鏈接制度了,那么也就意味著即使通過鏈接制度把這些桔皮書列出來的專利糾紛都解決了,還是可能面臨未列入桔皮書其它專利的侵權糾紛(比如說制備方法)。
再者,美國以及很多國家的制度設計是一審判決不侵權就可以上市,也就是地區法院判決不侵權就可以批準上市,那么要是一審判決后二審判決改判了呢?30個月,24個月還是9個月的遏制期屆滿后,專利糾紛還是沒有解決,藥品審批機關也會批準仿制藥上市,但如果仿制藥企業上市銷售其仿制藥產品的話,也可能也會面臨侵權責任。還有如果專利權人在仿制藥審批階段不提起訴訟呢?也就是說,鏈接制度只是提供給專利權人一個在仿制藥審批階段提起訴訟的機會,但如果專利權人不利用這個機會,而是等到仿制藥企業已經生產銷售仿制藥之后再起訴的話,即所謂的“放水養魚”,仿制藥企業上市其仿制藥后仍然存在法律不確定性。在鏈接制度實踐過程中,在美國、加拿大發生過這樣的問題。
美國在2003年后修改了藥品專利鏈接制度, 規定如果專利權人在藥品鏈接階段不起訴的話,仿制藥申請人可以提起確認不侵權之訴。而加拿大在2017年修改其專利鏈接制度后,則明確如果專利權人沒有在規定期限內起訴的話,此后再也不能就相同專利起訴該仿制藥企業。
關鍵詞: 專利代理 專利產品 專利 ?