一文看懂美國不同藥品申報路徑的知識產權制度

藥品作為一種特殊商品,必須確保其可及性,才能保障社會公眾的健康福利。
藥品可及性,一方面涉及通過鼓勵創新增加基本藥品的種類和數量,另一方面涉及通過支持仿制藥發展控制藥品可負擔的價格;
但是二者之間存在一定程度的沖突,因此,需要國家層面通過制度設計來尋求二者的平衡。
2017年以來我國開始進入醫藥行業政策的調整期,來自國家層面的醫藥政策文件頻發,包括SFDA于2017年5月12日發布的《關于鼓勵藥品醫療器械創新保護創新者權益的相關政策(征求意見稿)》,中共中央辦公廳和國務院辦公廳于2017年10月8日聯合發布的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,以及國務院辦公廳于2018年3月21日發布的《關于改革完善仿制藥供應保障及使用政策的意見》等。
作為全球醫藥龍頭的美國,在藥品監管過程中也經歷了平衡鼓勵新藥創新與促進仿制藥盡快上市之間關系的摸索過程。并最終通過藥品申報路徑設計、試驗數據保護制度、專利鏈接制度等的配合設計,對存在矛盾的各方關系進行了相對妥善的調和。
我國在進行制度設計和實施的同時,可以借鑒美國的相關經驗。需要我們對美國藥品上市審批制度和其相關知識產權制度配合設計機制深入了解。
美國藥品報批過程中,對于505(b)(1) 新藥申請, 505(b)(2) 新藥申請和505(j) 仿制藥申請這三種美國藥品審批路徑,涉及的知識產權問題各不相同,可以歸結為數據保護制度和專利保護制度。
數據保護制度
所謂數據保護制度,是藥品上市后市場獨占保護的一種行政手段,用于保護新藥開發商自主進行藥品開發的投資利益和積極性。具體指在藥品上市批準過程中,申請者必須向FDA提交與藥品研發相關的未披露試驗數據,以證明其申請注冊藥品的安全性和有效性,在一定的保護期內,FDA 或者未經許可的第三方均不得依賴這些數據批準或取得相關藥品的上市許可。
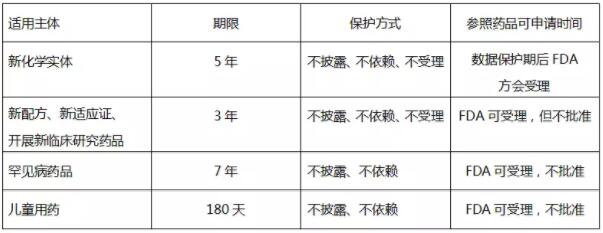
根據三種審批路徑適用對象的差異可知,數據保護制度主要適用于505(b)(1) 新藥申請和505(b)(2) 新藥申請。具體的數據保護類型及保護方式,規定于美國聯邦法規匯編21CFR314.108,見下表:
專利保護制度
藥品申報過程中的專利保護制度,可具體為專利鏈接制度。所謂藥品專利鏈接(patent linkage),是指藥品上市批準與創新藥品專利期滿相“鏈接”,即藥品注冊申請應當考慮先前已上市藥品的專利狀況,從而避免可能的專利侵權。
美國聯邦法規匯編中關于藥品的章節21CFR 314.53 規定,505(b)(1)申請人和505(b)(2)申請人在遞交新藥申請時需同時提交相關專利信息,新藥申請批準后,FDA會將專利信息在橘皮書上予以公布。21 CFR 314.50(i)要求,505(b)(2)申請人和505(j)申請人在遞交申請時需對橘皮書中所列參比藥物的相關專利逐個提交聲明,并將相關不侵權聲明遞交NDA 所有權人/專利權人。其中,專利聲明包括四種:
①橘皮書中沒有相關專利,申請人應遞交“第I 階段聲明”;
②相關專利已經過期,申請人應遞交 “第II 階段聲明”;
③雖有專利,但申請產品將于專利期屆滿后上市,申請人應遞交“第III 階段聲明”;
④認為專利不可執行、專利無效,或制造、使用及銷售申請藥品時不侵犯專利權,申請人應遞交“第IV 階段聲明”。
此外,對于用途專利,若申報的藥品用途未涵蓋在參比藥物橘皮書所列用途專利中,則仿制藥商只需提交一個第Ⅷ節聲明即可[1]。該聲明的使用前提為FDA 批準的藥品用途并沒有被原研藥商用途專利所窮盡,申請人可選擇不侵犯專利權的多個或一個用途來申請上市,即所謂的藥品標簽例外。
專利鏈接制度的糾紛解決機制
參比藥物批件持有人在收到第Ⅳ段聲明之日起45 日內,可以向聯邦法院提起訴訟,要求裁定相關專利有效,和/或505(b)(2)申請人和505(j)申請人侵權,并通知FDA 聯邦法院已經受理有關訴訟。但如果接到通知45 天之內,參比藥物批件持有人并未向法院提起訴訟請求,則經過符合條件的材料評審,FDA 便可批準產品上市。
如果參比藥物批件持有人提起訴訟,依照21 U.S.C. § 355(c)規定,FDA 將給予參比藥物批件持有人30 個月的時間解決專利糾紛,同時FDA會對產品繼續審評,但批準會自動推延30 個月。若在此期間FDA完成審評,并確認該藥品符合“安全性、有效性、質量可控性”要求,會頒發臨時批準(Tentative Approval)。需要注意的是,申請人不能基于臨時批準將藥品上市,直至法院判定侵權不成立,或30個月延遲期結束,FDA頒布最終批準,所申請的藥品才能夠上市。
若在30個月延遲期內,法院判定專利侵權成立則FDA立即結束審評,藥品不予批準上市。反之,FDA 繼續審評,或審評通過后頒發最終產品上市批準。
如果在30 個月(或寬限期)內,專利糾紛沒有結束,FDA 也將批準該藥品上市。但最后如若判定侵權成立,藥品廠商將面臨巨額的懲罰性侵權賠償。
關鍵詞: 專利申請 專利申請代理 知識產權 ?